Investiční stříbro - investice do stříbra
1. Proč stříbro
Pokud jste se dosud příliš nezabývali světem investic, pak první, co vás patrně napadne při návštěvě našich stránek, je otázka „Proč vlastně kupovat stříbro?“ Budete si také klást další otázky: "Mám nakupovat stříbro jako drahý kov? Nebo jde spíše o průmyslový kov?".
Stříbro je unikátní tím, že je vlastně obojím – kovem drahým i průmyslovým. Je však třeba zdůraznit jiné důležité hledisko - myšlenku kupovat stříbro jako peníze, respektive jako monetární kov.
Co jsou vlastně současné peníze? Nejsou to pouze papírové bankovky v peněžence. V každé ekonomické příručce se píše, že peníze jsou prostředkem směny, umožňují oceňování statků a slouží jako uchovávatel hodnot. S posledním tvrzením si dovolíme zásadně nesouhlasit.
Dnešní ničím nekryté peníze funkci uchovávatele hodnot plní velmi špatně, respektive ji neplní vůbec.
2. Výhody stříbra
Nyní je jasné, že investice do drahých kovů mají smysl. Proč ale právě stříbro a nikoliv třeba zlato?
Je pravdou, že zlato a stříbro jsou drahé kovy a mají tendenci chovat se podobně. Avšak stříbro má oproti zlatu řadu výhod, díky kterým má obrovský potenciál do budoucna.
Často s oblibou říkáme, že největším nepřítelem ceny zlata je samotné zlato. Vytěžené zlato se totiž téměř nijak nespotřebovává. Hlavní využití zlata je ve šperkařství a v oblasti investic. Odtud ale může být zlato velmi rychle přivedeno zpět na trh, jakmile jeho cena stoupne.
U stříbra je situace jiná. Drtivá většina každoročně vytěženého stříbra se spotřebovává v průmyslu, především v elektrotechnice. Velká část stříbra je nenávratně ztracena a nemůže být nikdy přivedena zpět na trh.
V trezorech centrálních bank je uloženo ohromné množství zlata. Zásoby stříbra bychom ve státních rezervách hledali marně. To je způsobeno dlouhodobým nedostatkem stříbra od 80. let minulého století, kdy deficit stříbra, vzniklý nedostatečnou těžbou, byl systematicky pokrýván ze státních rezerv a ze zásob investorů. Tyto zásoby se již zcela vyčerpaly.
Jaké je konkrétně využití stříbra?
To, co dělá stříbro výjimečným, jsou jeho fyzikální vlastnosti. Stříbro má nejvyšší elektrickou a tepelnou vodivost ze všech prvků. Díky tomu má i velmi široké využití. Lidé si zpravidla neuvědomují, kolik věcí kolem nás obsahuje stříbro. Počítač, televize, mobilní telefon, automobil, lednička...téměř každý elektrotechnický výrobek nemůže existovat bez většího či menšího dílu stříbra. Stříbro má významné uplatnění také v lékařství, v chemii (např úprava vody), ve šperkařství apod. Velkým překvapením pro mnohé je, jak ohromné množství stříbra spotřebuje zbrojní průmysl, například v raketách, v řízených střelách, v torpédech a v ponorkách. Obrovský potenciál využití stříbra je v technologiích budoucnosti: ve fotovoltaických článcích (kde se již dnes hojně využívá), v nanotechnologiích (protože v elektrotechnice nové generace je potřeba velmi omezovat zahřívání vodičů v důsledku elektrické rezistivity) a také v nových stříbro-zinkových bateriích, které mají ambici v blízké budoucnosti úplně nahradit dnešní masově rozšířené lithio-iontové baterie. Tyto nové „stříbrné“ baterie mají o polovinu vyšší výdrž. Nehrozí u nich nebezpečí exploze, nejsou toxické. Již v brzké budoucnosti se mají objevit první notebooky s těmito akumulátory, spekuluje se o firmách Apple a Lenovo.
Novým odvětvím z hlediska využití stříbra je také textilní průmysl. Neuvěřitelných 1200 tun stříbra se ročně spotřebuje při výrobě nového polyesterového oblečení s vetkanými mikroskopickými stříbrnými vlákny! Stříbro totiž působí dezinfekčně, resp má antibakteriální účinky. Příčinou vzniku zápachu při pocení jsou bakterie množící se na povrchu kůže. Eliminací těchto bakterií (právě přítomností stříbra) lze odstranit zápach a není třeba používat deodorant. Poslední roky také velmi razantně narůstá objem investic do stříbra – prozíraví investoři vytušili obrovské perspektivy využití stříbra a tak v tichosti nakupují, dokud je cena příznivá.
Jaké jsou možnosti získávání stříbra?
 Samozřejmě hlavním zdrojem stříbra je těžba. Při pročítání předchozího odstavce Vás možná napadlo, že s poklesem průmyslové výroby v důsledku hospodářské krize poklesla také poptávka po stříbře. To přece může mít negativní dopad na cenu stříbra? Ano, to je pravda. Ovšem narozdíl od zlata jsou celé 2/3 vytěženého stříbra získávány jako vedlejší produkt při těžbě základních kovů (zinek, olovo, nikl a měď). Vzhledem k drastickému poklesu poptávky po základních kovech došlo k uzavíraní velkého počtu dolů. Pokles těžby základních kovů tedy logicky znamená také významný pokles produkce stříbra. Propad těžby stříbra byl takový, že více než vyrovnal pokles poptávky po stříbře v průmyslu.
Samozřejmě hlavním zdrojem stříbra je těžba. Při pročítání předchozího odstavce Vás možná napadlo, že s poklesem průmyslové výroby v důsledku hospodářské krize poklesla také poptávka po stříbře. To přece může mít negativní dopad na cenu stříbra? Ano, to je pravda. Ovšem narozdíl od zlata jsou celé 2/3 vytěženého stříbra získávány jako vedlejší produkt při těžbě základních kovů (zinek, olovo, nikl a měď). Vzhledem k drastickému poklesu poptávky po základních kovech došlo k uzavíraní velkého počtu dolů. Pokles těžby základních kovů tedy logicky znamená také významný pokles produkce stříbra. Propad těžby stříbra byl takový, že více než vyrovnal pokles poptávky po stříbře v průmyslu.
Zároveň bylo uzavřeno i hodně klasických stříbrných dolů. Těžařské společnosti často při provozu spoléhají na úvěry. S vyschnutím likvidity na mezibankovním trhu mnoho těžebních společností nedokázalo získat úvěr a musely těžbu ukončit. Dalším významnějším zdrojem stříbra už je pouze recyklace. Velkým úskalím recyklace je, že stříbro se sice používá téměř všude, ale v tak malých množstvích, že recyklovat jej zpět je technologicky velmi složité. Rentabilita recyklace stříbra je proto problematická.
Zlepšit situaci by mohl prodej ze státních rezerv a výkup od investorů. Jak jsme si ale již ukázali, tento dříve velmi významný zdroj dnes již prakticky neexistuje. Zásoby uložené ve státních rezervách jsou již vyčerpané.
Dá se tedy očekávat, že dopady hospodářské krize budou pokračovat, avšak budou ovlivňovat jak poptávku, tak i nabídku. Je také třeba si uvědomit, že stříbro se nepoužívá v těžkém průmyslu, který je krizí zasažen nejvíc. Stříbro se používá spíše v lehkém průmyslu a v nových vysoce technologických oborech (zmíněných výše), které odolávají krizi mnohem lépe a z dlouhodobého hlediska u nich lze předpokládat značný růst.
Na začátku tohoto článku jsme zmínili, že stříbro se používá téměř všude, avšak ve velmi malých množstvích. Dopad ceny stříbra na celkovou cenu výrobku je tedy zanedbatelný. I kdyby stříbro několikanásobně zdražilo, výrobci se nebudou snažit vyvíjet náhradu, neboť v ceně výrobku tvoří stříbro pouze malou část. Ba naopak, výrobci se budou snažit získat dostatečné zásoby i za vysokou cenu, aby zajistili plynulý běh výroby. Skutečností je, že v mnoha výrobcích je stříbro nenahraditelné. Ano, v typickém výrobku je ho sice velmi málo, ale bez něj výrobek prostě nelze vyrobit.
Když dojde k nedostatku fyzického stříbra, není možné mávnutím kouzelného proutku otevřít nové doly. Vybudovat nový důl trvá 10 let i více. V dnešním světě už prakticky neexistují naleziště, kde by se stříbro vyskytovalo v dostatečné koncentraci. Ekonomicky rentabilních nalezišť je velmi málo.
Uděláme-li si shrnutí poptávky a nabídky po stříbře, dospějeme k závěru, že stříbro ubývá mnohem rychleji, než se stačí těžit i recyklovat. Ve světě se pro tento fenomén vžil název "Silver deficit". Moudří a prozíraví investoři o tomto deficitu vědí, o čemž svědčí rostoucí zájem o investiční stříbro. Deficitu stříbra se samozřejmě budeme podrobněji věnovat v investorské sekci.
3. Srovnání se zlatem
Velmi významným indikátorem v oblasti drahých kovů je tzv. „Gold/Silver ratio“ (poměr Zlato/Stříbro), který určuje aktuální poměr mezi cenou zlata a stříbra.
V současnosti má tento poměr hodnotu asi 60:1. To znamená, že teoreticky si za jednu trojskou unci zlata můžeme koupit 60 uncí stříbra. Tento poměr však ani vzdáleně neodpovídá současné nabídce a poptávce po stříbře.
Historicky (tj. po několik tisíc let) byl tento poměr okolo 15:1.
Je zajímavé, že toto číslo velmi dobře odpovídá skutečnému zastoupení stříbra a zlata v přírodě (respektive v zemské kůře), které činí 17:1.
V předchozím článku jsme si řekli, že stříbra v posledním století významně ubylo, naopak zásob zlata spíše přibývá. Kolik zlata a stříbra je tedy vlastně dnes k dispozici? Velmi názorný přehled dává tento schematický obrázek.
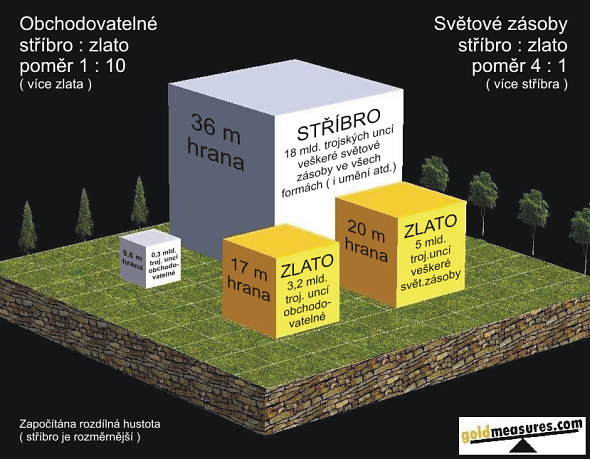
Jak vidíme, dnes je po celém světě ve všech formách (tedy včetně uměleckých předmětů apod.) jen zhruba čtyřikrát více stříbra než zlata. Pokud bychom se omezili pouze na kov, který je aktuálně dostupný na trhu,zjistíme zajímavou věc – stříbra je méně než zlata! Ano, pokud porovnáme fyzické zlato a stříbro, které můžeme nyní koupit na světových trzích, pak stříbra je dokonce desetinásobně méně než zlata!
Jak je ale možné, že dnešní poměr cen zlata a stříbra tomuto zastoupení neodpovídá? Příčin je několik. Tou hlavní je manipulace s cenou stříbra na komoditních futures burzách, především na COMEXu. Zde se obchoduje s "papírovými" kontrakty na stříbro, kterých je prodáváno mnohem více, než vůbec existuje podkladového fyzického stříbra. Druhým faktem je určitá nedoceněnost, resp. chybné vnímání stříbra v očích laické veřejnosti.
Od doby, kdy stříbro přestalo být používáno jako mincovní kov, ekonomové a analytici z různých makléřských společností mívají tendenci označovat stříbro nikoliv jako drahý kov, ale jako průmyslový kov. Proto velká část lidí vnímá stříbro jako méněcenné, pod pojmem „peněžní kov“ si asociuje pouze zlato. Tento "mýtus" se naprosto nezakládá na pravdě.
 Historicky bylo jako peníze využíváno především stříbro, nikoliv zlato. Důvody jsou praktické – stříbra bylo více, mělo menší cenu a hodilo se tedy pro běžnou směnu zboží. Zlato bylo hromaděno spíše bohatšími vrstvami jako uchovávatel bohatství. Právě proto Gold/Silver ratio po většinu historie favorizovalo spíše stříbro. Dokonce i americký dolar byl v roce 1792 (Coinage Act) oficiálně definován jako zhruba 400 grainů (cca 27 gramů) stříbra. Tedy nikoliv jako papírek vyrobený z bavlněné buničiny, opatřený pěkným zeleným potiskem.
Historicky bylo jako peníze využíváno především stříbro, nikoliv zlato. Důvody jsou praktické – stříbra bylo více, mělo menší cenu a hodilo se tedy pro běžnou směnu zboží. Zlato bylo hromaděno spíše bohatšími vrstvami jako uchovávatel bohatství. Právě proto Gold/Silver ratio po většinu historie favorizovalo spíše stříbro. Dokonce i americký dolar byl v roce 1792 (Coinage Act) oficiálně definován jako zhruba 400 grainů (cca 27 gramů) stříbra. Tedy nikoliv jako papírek vyrobený z bavlněné buničiny, opatřený pěkným zeleným potiskem.
Jako drahý kov je stříbro stále vnímáno především v Indii, v Číně, v ropných státech Blízkého Východu, v Mexiku a obecně v mnoha zemích v Asii. Tyto státy nyní bohatnou velmi rychlým tempem. Dá se předpokládat, že tento trend bude pokračovat. To bude dále zvyšovat poptávku po stříbře. Ještě více se proto prohloubí nerovnováha nabídky a poptávky. "Silver deficit" se zvýší. USA a vyspělé státy Evropy nebudou schopny donekonečna táhnout břemeno obrovského zadlužení veřejných rozpočtů - na scénu přijde inflace, možná i hyperinflace. Jsme přesvědčeni, že uvedené skutečnosti radikálně změní pohled lidí ve vyspělých státech na drahé kovy. Vítězem, z racionálního i z praktického hlediska, bude stříbro. Stříbro, jež bude znovu vnímáno jako skutečné a inflaci nepodléhající peníze.
Stříbro aneb vše o stříbře - zdroj Wikipedie
| Stříbro | |
 |
|
| Chemická značka | Ag (lat. Argentum) |
| Atomové číslo | 47 |
| Relativní atomová hmotnost | 107,8682 amu |
| Elektronová konfigurace | [Kr] 4d10 5s1 |
| Skupenství | Pevné |
| Teplota tání | 961,78 °C, tj. 1 234,93 K |
| Teplota varu | 2 162–2 212 °C, tj. 2 435–2 485 K (různé zdroje) |
| Elektronegativita(Pauling) | 1,63 |
| Oxidační číslo | 1, 2, 3 |
| Hustota | 10,490 g.cm-3 |
| Tvrdost | 2,5 (Mohsova stupnice tvrdosti) |
Stříbro, chemická značka Ag (lat. Argentum) je ušlechtilý kov bílé barvy, používaný člověkem již od starověku. Vyznačuje se nejlepší elektrickou a tepelnou vodivostí ze všech známých kovů. Slouží jako součást různýchslitin pro použití v elektronickém průmyslu, výrobě CD i DVD nosičů ašperkařství, jeho sloučeniny jsou nezbytné pro fotografický průmysl.
Obsah[skrýt] |
[editovat]Základní fyzikálně-chemické vlastnosti
Typický kovový prvek, známý již od starověku. Z prvků vykazuje nejlepší elektrickou i tepelnou vodivost. Po mechanické a metalurgické stránce je velmi dobře zpracovatelné – má dobrou kujnost a dobře se odlévá (dobrá zatékavost).
Patří mezi přechodné prvky, které mají valenční elektrony v d-sféře. Ve sloučeninách se vyskytuje především v mocenství , sloučeniny dvojmocného stříbra Ag+2 jsou nestálé a mají silné oxidační schopnosti. Stříbro Ag+3 je nutné z důvodu jeho nestálosti stabilizovat velkými anionty.
Přestože je stříbro řazeno mezi drahé kovy, které se obecně vyznačují značnou chemickou stabilitou, je velmi dobře rozpustné v kyselině dusičnépředevším díky jejím silným oxidačním vlastnostem. Reakce probíhá podle rovnice:
- 3 Ag + 4 HNO3 → 3 AgNO3 + NO + 2 H2O
Podobně se stříbro chová i vůči koncentrované kyselině sírové, která působí taktéž oxidačně. Vůči zředěné H2SO4 je však stříbro netečné, stejně při působení dalších minerálních kyselin. Za přítomnosti kyslíku se stříbro rozpouští i roztocích alkalických kyanidů za vzniku kyanostříbrnanového iontu [Ag(CN)2]-
Na suchém čistém vzduchu je stříbro neomezeně stálé. Stačí však i velmi nízké množství sulfanu(sirovodíku) H2S, aby stříbro začalo černat, protože na jeho povrchu vzniká vrstva sulfidu stříbrného Ag2S.
[editovat]Výskyt a výroba
V zemské kůře se stříbro vyskytuje pouze vzácně. Průměrný obsah činí kolem 0,07 – 0,1 mg/kg. V mořské vodě činí jeho koncentrace přibližně 3 mikrogramy v jednom litru. Předpokládá se, že ve vesmíru připadá na jeden atom stříbra přibližně 1 bilion atomů vodíku.
V přírodě se stříbro obvykle vyskytuje ve sloučeninách, vzácně však i jako ryzí kov. Téměř vždy je stříbro příměsí v ryzím přírodním zlatě. Z minerálů stříbra je nejvýznamnější akantit a jeho vysokoteplotní modifikace (nad 179 °C) argentit Ag2S.
Jako zdroj pro průmyslové získávání stříbra jsou však rudy olova, mědi, niklu nebo zinku. Nejvíce používanou metodou pro získávání i čištění ryzího stříbra je elektrolýza, z halogenidůje však možno jej jako ryzí získat i pyrometalurgicky přímým tavením.
Největšími světovými producenty stříbra jsou Mexiko, Kanada, Peru, Austrálie a USA. VČechách se ve středověku dobývalo značné množství stříbrných rud. Nejznámější lokalitou je patrně Kutná Hora – kromě dobývání a rafinacestříbra zde vznikla i královská mincovna, kde byly raženy známé stříbrné groše. Další lokality s výskytem stříbrných rud nalezneme i vKrušných horách a na Českomoravské vysočině.
[editovat]Využití
Elementární stříbro je v praxi využíváno především pro své unikátní fyzikální vlastnosti – vynikající elektrickou a teplotní vodivost, relativně dobrou chemickou stabilitu a odolnost vůči vlivům okolního prostředí a vysokou odrazivost pro viditelné světlo. Uplatní se zde jak kovové elementární stříbro, tak především jeho slitiny s dalšími kovy.
[editovat]Kovové stříbro
- Velmi tenká vrstva kovového stříbra se využívá jako záznamové médium na CD a DVD kompaktních discích. Vrstva stříbra se vakuově nanáší na plastovou podložku a po překrytí další plastovou vrstvou se na ni zaznamenávají stopy generované laserem, který poté slouží i pro čtení uloženého záznamu. Pro zvláště důležité aplikace (některé počítačové hard disky) se využívá směsí stříbra s menším množstvím platiny. U levnějších variant záznamových médií může být stříbro naopak nahrazeno hliníkem.
- Vysoké optické odrazivosti stříbra se již po dlouhou dobu využívá při výrobě kvalitních zrcadel. Zde je tenká vrstva stříbra nanášena na skleněnou podložku a druhou skleněnou deskou je chráněna proti korozi atmosférickými plyny.
- Stříbro jako drahý kov je materiálem pro výrobu pamětních mincí a medailí. Stříbrné mince byly raženy již ve starověku (Egypt, římská říše) i ve středověku (Pražské groše). Ve sportu je v současné době stříbrná medaile udělována sportovci, který obsadil druhé pořadí v určité disciplíně. Mnohdy jsou ovšem tyto medaile pouze pokrývány povrchovou vrstvou stříbra, obvykle elektrolyticky. K výročí různých významných událostí jsou často vydávány pamětní mince. Opět buď z čistého stříbra nebo stříbrem pokryté.
- Kovové stříbro i jeho sloučeniny jsou základním prvkem vysoce účinných miniaturních elektrických článků (baterií), používaných v moderních náramkových hodinkách a mnoha dalších malých elektrických spotřebičích.
- V organické syntetické chemii jsou stříbro a jeho sloučeniny využívány jako katalyzátoryněkterých oxidačních reakcí. Příkladem je výroba formaldehydu oxidací methanolu.
- V magických aplikacích bylo stříbro odpradávna pokládáno za velmi účinný prostředek proti působení temných sil. Například jedním z několika skutečně účinných způsobů likvidacevlkodlaka je jeho zastřelení kulkou z čistého stříbra.
[editovat]Slitiny stříbra
Samotné stříbro je poměrně měkké a je náchylné k černání při styku se sloučeninami síry v atmosféře. Proto se pro praktické aplikace obvykle slévá s jinými kovy, které zlepší jak jeho mechanické, tak vzhledové vlastnosti.
- Klenotnické zlaté slitiny obsahují téměř vždy určité procento stříbra. Naopak klenotnické stříbro je obvykle slitinou s obsahem kolem 90 % stříbra, doplněné mědí. Pro zvýšení povrchové kvality stříbrných šperků (lesk, odolnost) se někdy tyto předměty pokrývají velmi tenkými vrstvičkami kovového rhodia.
-
V medicíně nacházejí uplatnění slitiny stříbra především v dentálních aplikacích. Relativní zdravotní neškodnost a chemická odolnost stříbra se uplatňuje především ve slitinách s převládajícím obsahem palladia, ale existuje celá řada dentálních slitin na bázi zlata, které obsahují menší množství stříbra.
- Speciálním případem dentálního využití stříbra jsou amalgámy. Tyto slitiny se používají jako výplně otvorů vzniklých po odvrtání zubního kazu. Jejich hlavními složkami je rtuť a slitiny stříbra s mědí a cínem.
- Velmi významné místo patří slitinám stříbra jako základu pájek pro využití především v elektrotechnice. Stříbrné pájky se vyznačují vysokou elektrickou vodivostí, tvrdostí a relativně vysokým bodem tání. Slitiny stříbra s cínem, kadmiem a zinkem slouží v elektrotechnice jako spojovací materiál pro konstrukci plošných spojů a další aplikace.
[editovat]Sloučeniny
Z pohledu praktického využití je nejvýznamnější sloučeninou stříbra dusičnan stříbrný AgNO3. Je to bílá krystalická látka, velmi dobře rozpustná ve vodě. Lze ji připravit ve velmi vysoké čistotě, nejlépe elektrolytickým rozpouštěním čistého stříbra v roztoku kyseliny dusičné. Tato sloučenina poté slouží v chemické výrobě jako zdroj stříbrných iontů pro další reakce.
Sulfid stříbrný Ag2S je černá, nerozpustná sloučenina, jejíž vznik způsobuje černání stříbrných předmětů působením i stopových množstvísulfanu (sirovodíku) v atmosféře. Ag2S patří mezi nejméně rozpustné známé soli anorganických kyselin.
Halogenidy stříbra jsou ve vodě většinou nerozpustné sloučeniny, nacházející hlavní využití ve fotografickém průmyslu. Jejich poněkud rozdílných vlastností se využívá i v analytické chemii k důkazu i stanovení některých anionů.
- Chlorid stříbrný AgCl je čistě bílý a je velmi dobře rozpustný v amoniaku. Vzniká při argentometrické titraci chloridů roztokem dusičnanu stříbrného, používá se při výrobě fotografických filmů a papírů.
- Bromid stříbrný AgBr je slabě nažloutlý a v amoniaku se rozpouští poměrně obtížně a pomalu. Vzniká při argentometrické titraci bromidů roztokem dusičnanu stříbrného, používá se při výrobě fotografických filmů a papírů.
- Jodid stříbrný AgI je žlutý a v amoniaku zcela nerozpustný. Vzniká při argentometrické titraci jodidů roztokem dusičnanu stříbrného, používá se např. při pokusech o umělé vyvolání deště, kdy jsou mikroskopické krystalky této látky rozptylovány z letadla do oblaků a slouží jako kondenzační jádra, na nichž vznikají první kapky dešťové vody.
Ve vodě je rozpustný pouze AgF.
Argentometrickou titrací je možno určit například množství halogenidových iontů v mořské vodě. Uveďme příklad: Chceme-li určit ve vzorku mořské vody obsah chloridových aniontů, zjistíme ho výpočtem ze součinu rozpustnosti chloridu sodného NaCl. Při určování ale musíme mít na vědomí, protože titrací vzniká sraženina, že sraženinu nevytváří jen chloridový anion, ale i bromidový a jodidový, a to ještě daleko ochotněji než chloridový. Tudíž musíme počítat s tím, že výsledek výpočtu nebude úplně přesný.
[editovat]Fotografický proces
- Podrobnější informace naleznete v článku Vyvolávání filmu.
Sloučeniny stříbra jsou základem celého průmyslového odvětví – fotografického průmyslu, které se zabývá výrobou produktů pro získávání fotografie a filmů.
[editovat]Biologický význam stříbra
Stříbro, jako většina ostatních těžkých kovových prvků, je v lidském organizmu přítomno pouze ve stopových množstvích.[zdroj?] Stříbro obecně působí především baktericidně a desinfekčně.[zdroj?]
Baktericidních vlastností stříbra se využívá i při jednorázové dezinfekci menších zdrojů pitné vody (studny). Je součástí vojenských pohotovostních souprav, které umožní v terénu získat pitnou vodu i z velmi znečistěných zdrojů.[zdroj?]
[editovat]Zdravotní rizika
Ve vyšších dávkách a koncentracích je však působení stříbra na organizmus negativní. Při styku pokožky roztoky Ag+ dochází ke vzniku tmavých skvrn – komplexních sloučenin stříbra a bílkovin v pokožce. Dlouhodobý vysoký přísun stříbra vede k jeho ukládání do různých tkání, především do kostí. O případné karcinogenitě a míře toxických účinků solí stříbra se doposud vedou spory a probíhá zde další výzkum.
[editovat]Ekologická rizika
Americký výzkum ukázal, že nanočástice stříbra o průměru 30 nanometrů a menší se ukládají v tkáních vyvíjejících se embryí ryb a mohou vyvolat závažné malformace včetně krevních výronů do hlavy a otoků, které vedou k úhynu rybích larev.[1]
[editovat]Související články
[editovat]Reference
- ↑ OTČENÁŠKOVÁ, Martina. Nanočástice mohou zabíjet rybí embrya [online]. Český rozhlas, 2010-3-3, [cit. 2010-03-04]. Dostupné online.(čeština)
[editovat]Literatura
- Cotton F.A., Wilkinson J.:Anorganická chemie, souborné zpracování pro pokročilé, ACADEMIA, Praha 1973
- Holzbecher Z.:Analytická chemie, SNTL, Praha 1974
- Dr. Heinrich Remy, Anorganická chemie 1. díl, 1. vydání 1961
- N. N. Greenwood - A. Earnshaw, Chemie prvků 1. díl, 1. vydání 1993 ISBN 80-85427-38-9
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| H | (přehled) | He | |||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr |
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe |
| Cs | Ba | * | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| Fr | Ra | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| *Lanthanoidy | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | ||
| **Aktinoidy | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||









